04
2022-08
Citation 导言 结直肠癌(CRC)是第三大常见癌症,占全球所有新癌症病例的10%,是全球癌症相关死亡的第二大原因,导致2020年近100万人死亡,且年轻者发病率不断上升[1,2]。在中国,结直肠癌的新发病人数仅次于肺癌,成为第二大癌症,据最新数据,我国83%的结直肠癌患者在首次确诊时处于中晚期,其中44%的患者已经出现了肝、肺等部位的转移。尽管当前结直肠癌的治疗策略有了进步,但结直肠癌患者的预后仅略有改善,而开发新治疗方法PI3K/mTOR抑制剂对携带RNF43 p.G659fs突变的结直肠癌患者是否具有治疗应用价值亟待对疾病机制的了进一步了解,确定关键基因变异的特定功能对于促进新的靶向治疗方法至关重要,并最终改善患者的预后。
研究背景
RNF43基因(Ring Finger Protein 43)编码一种环型E3泛素连接酶,它作为Wnt信号通路的负调节因子主要是通过降解Wnt受体Frizzled来实现。因此,RNF43功能的丧失将导致肿瘤细胞依赖分泌的Wnt配体来存活[3-5]。 RNF43是CRC和其他恶性肿瘤中经常发生突变的基因,且RNF43 p.G659fs突变在约8%的CRC患者中出现,尤其是在DNA错配修复缺陷(dMMR)/高微卫星不稳定性(MSI-H)的患者中更常见[6],但其作为热点突变的功能影响还有待进一步研究,且也没有针对的特定疗法,探索其中机制对新疗法开发至关重要。 本文小编将带大家一起看看这篇刊登于Nature Communications的文章:RNF43 G659fs is an oncogenic colorectal cancer mutation and sensitizes tumor cells to PI3K/mTOR inhibition(译名:结直肠癌致突变RNF43 G659fs可使肿瘤细胞对PI3K/mTOR抑制剂敏感),从机制上探索PI3K/mTOR抑制剂对携带RNF43 p.G659fs突变的结直肠癌患者是否具有治疗应用价值。
研究背景
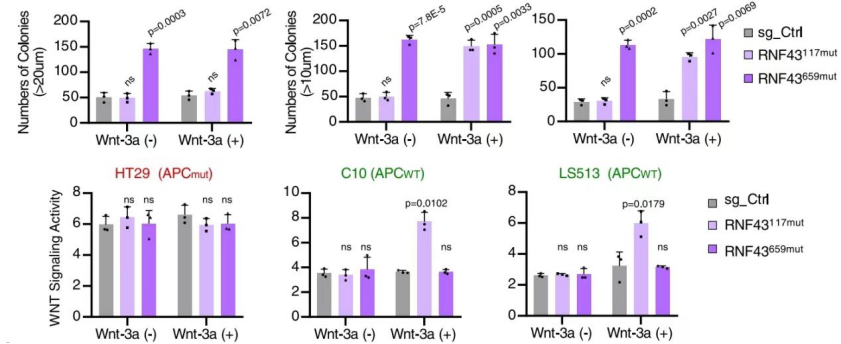
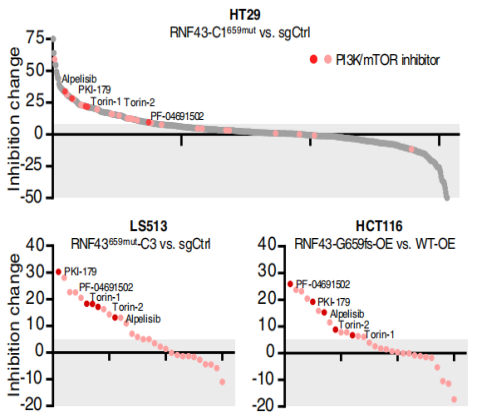
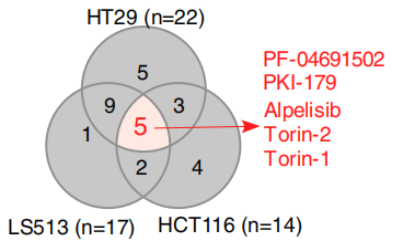
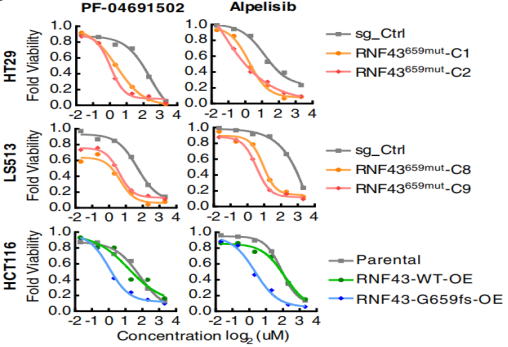
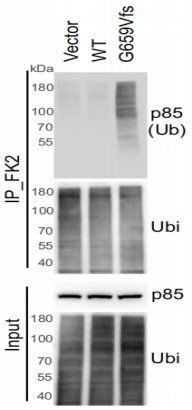
RNF43659mut具有不依赖Wnt的致癌作用 为研究RNF43上两个热点移码突变(p.R117fs和 p.G659fs)的功能。经过CRISPR-Cas9编辑构建的RNF43117mut和RNF43659mut等基因细胞系。在培养之初加入Wnt-3a,结果显示,与对照组相比,RNF43117mut组在加入Wnt-3a后生长显著加速。而RNF43659mut组没有明显差别(图1)。且RNF43659mut组增加了三个株系聚落形成(图1),而这些聚落的形成与Wnt-3a和APC无关。表明了RNF43117mut的功能是Wnt依赖性的,而RNF43659mut不是。为了进一步验证结果,使用TOP/FOP荧光素酶报告分析测量Wnt信号活性。发现补充Wnt-3a的RNF43117mut组显著增加Wnt信号。与对照组相比,RNF43659mut组Wnt信号未显著增加(图2) 图1 图2 (注:荧光素酶报告物测定所示CRISPR编辑细胞中的Wnt信号活性) RNF43659mut激活PI3K/AKT信号通路,易受PI3K/mTOR抑制剂的影响 为了发现RNF43659mut CRC细胞潜在的治疗药物,对RNF43659mutCRC细胞进行了全面的药筛。在5363种处于临床前和临床开发不同阶段的化合物列表中,分别筛选出了30种和22种PI3K/mTOR途径的药物。与二甲基亚砜处理和等基因对照相比,该途径在选择性靶向RNF43659mut的重组文库化合物中显著富集(图3)。发现五种化合物alpelisib,PF-04691502,PKI-179,Torin-1和Torin-2,在RNF43659mut等基因细胞系中表现出显著的选择性杀伤效果(图4,6)。此外,对RNF43 p.G659fs 过表达细胞中使用五种化合物的剂量-反应曲线中,五种化合物对RNF43659mut细胞和过表达RNF43659mut细胞显示出有效和选择性毒性,但对sgRNA对照细胞或野生型过表达细胞没有毒性(图5)。这些结果共同证明了RNF43659mut激活PI3K/AKT信号,PI3K/mTOR抑制剂可以靶向杀伤RNF43659mut突变的肿瘤。 图3 图4 图5 Venn图显示HT29、LS513 RNF43659mut编辑细胞和HCT116 RNF43659mut过度表达细胞中PI3K/mTOR显著候选化合物重叠(红色),其中n为在每个细胞系的二次筛选中验证的主筛选中的化合物数量 图6 CRC RNF43 G659fs临床前模型中PI3K/mTOR复合效率的评估 RNF43659mut通过RNF43659mut-p85相互作用激活PI3K/AKT信号 研究发现RNF43 p.G659fs突变在体外和体内激活PI3K,并表明这种激活是通过降解PI3K调节亚基p85发生的。在突变体中,RNF43 p.G659fs通过结合降解p85来消除p85对PI3K/AKT信号的抑制,从而激活PI3K/AKT信号,加快癌细胞的生长,并且RNF43 p.G659fs诱导的PI3K/AKT信号激活可以被PI3K/mTOR抑制剂逆转。这也进一步证明PI3K/mTOR抑制剂能通过直接抑制PI3K/AKT信号,从而抑制携带RNF43 p.G659fs突变肿瘤细胞的生长。 图7 泛素免疫沉淀分析评估观察到RNF43659mut增加了P85的泛素化 RNF43659mut调节干扰素基因表达 研究对RNF43659mut等基因细胞系的RNA测序揭示了降低干扰素-α和-γ反应的基因表达,这些基因集分别有助于炎症反应和先天性免疫反应,且这种降低的活性可以被PI3K/mTOR抑制剂恢复,这说明RNF43659mut可能改变肿瘤免疫环境。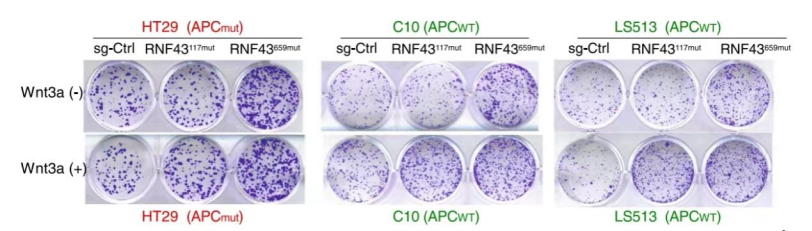

研究结论
本研究证明了RNF43 p.G659fs突变具有不依赖Wnt的致癌作用,RNF43 p.G659fs与p85亚基结合降解,消除p85对PI3K/AKT信号通路的抑制作用,可导致PI3K信号增强,因而PI3K/mTOR抑制剂可以逆转p.G659fs诱导的PI3K/AKT信号通路的激活,它可对携带该突变的结直肠肿瘤选择性杀伤。验证了PI3K/mTOR抑制剂在治疗RNF43 p.G659fs突变型癌症中具有应用价值,另外基于RNF43659mut调节干扰素基因表达,也提出了将免疫治疗和PI3K/mTOR抑制剂结合进行治疗的可能性,尤其是治疗失败的DNA错配修复缺陷(dMMR)/高微卫星不稳定性(MSI-H)结直肠癌患者。因此对RNF43 p.G659fs突变型结直肠癌的研究发现为未来治疗新方法的开发拓展了新视野。
研究启示
文中建立了CRC患者来源的类器官,肿瘤组织取自患者来源的RNF43_G659fs异种移植模型。同时也建立正常的患者来源的结肠类器官。应用类器官进行药物处理,验证了PI3K/mTOR抑制剂在RNF43659mut等基因细胞系和异种移植模型(PDX),以及在患者来源的含有RNF43 p G659fs突变的类器官中都产生了良好的抗肿瘤活性。 作者之所以如此选择,因为不同的模型都有其自身的局限性,细胞系包含的细胞类型过于单一,丧失了肿瘤的异质性。而人源肿瘤异种移植模型,不仅存在人鼠之间物种的差异,而且成本高昂、建模周期长和建模成功率低,也无法高通量使用等问题。相比来说,类器官具有拟合度高、培养周期短、传代稳定、易自动化等优势,具备了高通量使用的条件。 类器官技术是科技部发布了“十四五”国家重点研发计划的6个重点专项之一,由于类器官技术本身具有极高的创新性,类器官已成为疾病研究、新药开发领域最受瞩目的模型,深受基金项目申请和高分杂志的青睐,使用类器官发表文章及申请国自然都是很有优势的。 广州精科医学检验所有限公司 广州精科医学检验所有限公司是精科生物集团旗下的全资子公司,是一家以类器官技术+基因组学技术为双驱核心的第三方医学检验所。公司在类器官方向致力于推动类器官技术的转化与应用,在科研上打造全面的类器官技术服务体系,而在临床上提供高效的类器官+NGS的综合检测服务。 ★ PIC.08 精科肠癌类器官 HE图片 参考文献 [1]Siegel, R. L., Miller, K. D. & Jemal, A. Cancer statistics, 2020. CA Cancer J. Clin. 70, 7–30 (2020). [2]Cancer Genome Atlas Network. Comprehensive molecular characterization of human colon and rectal cancer. Nature 487, 330–337 (2013). [3]Wong, C. C. et al. SLC25A22 promotes proliferation and survival of colorectal cancer cells with KRAS mutations and xenograft tumor progression in mice via intracellular synthesis of aspartate. Gastroenterology 151, 945–960 (2016). [4]Liu, X. et al. Inhibition of PCSK9 potentiates immune checkpoint therapy for cancer. Nature 588, 693–698 (2020). [5]Roig, A. I. et al. Immortalized epithelial cells derived from human colon biopsies express stem cell markers and differentiate in vitro. Gastroenterology 138, 1012–1021 (2010). [6]Zhang, L. et al. Selective targeting of mutant adenomatous polyposis coli (APC) in colorectal cancer. Sci. Transl. Med. 8, 361ra140 (2016).