11
2022-08
Citation
引文
结直肠癌(CRC)是世界第三大常见癌症,是我国发病人数第二高的癌症,仅次于肺癌。且近几年发病率和死亡率都呈现上升趋势,虽针对结直肠癌EGFR突变研发的靶向药在一定程度上改善了患者的生存,但仍有大量患者携带KRAS突变,无法从中受益,因此新的靶向治疗的开发至关重要。
研究背景
结直肠癌的病变与一系列基因突变有关,其中APC和KRA就是其中常见的突变基因。APC功能的丧失是大肠癌发生的早期事件之一,约85%的结直肠癌存在APC的缺陷。同时,45%的CRC会发生KRAS突变,并驱动CRC进展。APC丢失和KARS的突变协同诱导结直肠癌的耐药性,增加治疗难度,因此,迫切需要针对APC/KRAS突变的结直肠癌新疗法。合成致死筛选结果显示CRISPR/Cas9敲除胆固醇生物合成基因与细胞活力的不相容,证明了胆固醇生物合成对肿瘤发展至关重要[6]。但是他汀类药物对于CRC的治疗效果有限,然而目前尚未清楚影响APC/KRAS突变型结直肠癌的是胆固醇生物合成途径中哪些中间代谢物影响后续级联反应。为此,研究团队展开试验旨在确认影响APC/KRAS突变型CRC的胆固醇代谢途径和验证PCSK9对APC/KRAS突变型结直肠癌的影响。
而类器官技术由于其能够最大程度还原体内细胞三维结构和原代组织的生理学、组织学、遗传学等特征在近几年倍受科研人员和临床医生的欢迎。近些年,越来越多学者对利用类器官模型得到的实验证据表达高度认可并运用于研究中。

今天,小编就来带大家看一篇2022年7月发布于Nature子刊的一篇名为The cholesterol uptake regulator PCSK9 promotes and is a therapeutic target in APC/KRAS-mutant colorectal cancer (IF:11.8780)的APC/KRAS结直肠癌新治疗靶点机制研究前沿文章。
团队研究确定PCSK9是调节胆固醇稳态的关键基因,PCSK9过表达可诱导癌变减少胆固醇摄取,在APC/KRAS突变型CRC中诱导胆固醇从头生物合成,并伴有香叶基香叶基二磷酸(GGPP)增加,该代谢产物可激活KRAS/MEK/ERK级联反应以促进肿瘤细胞生长。团队利用CRC等基因细胞系、类器官和异种移植模型验证了PCSK9抑制剂对APC/KRAS突变型CRC肿瘤的靶向杀伤效果,特别是与辛伐他汀联合使用,表明PCSK9是大部分CRC患者的治疗靶点,而且PCSK9过表达可预测APC/KRAS突变型CRC患者的生存率较差。
研究思路
01
揭示APC/KRAS突变型CRC的胆固醇异常代谢
02
评估胆固醇代谢途径在APC/KRAS突变型CRC中的作用
03
评估APC/KRAS突变型CRC胆固醇代谢机制的变化
04
揭示PCSK9在APC/KRAS突变型CRC中的作用
05
验证PCSK9抑制剂对CRC的抑制作用
研究结果
1
APC/KRAS突变型CRC在
胆固醇生物合成途径中富集
运用癌症基因图谱(TCGA)和结肠直肠癌(COAD-READ)队列的RNA-seq数据集进行基因富集分析,结果显示APC/KRAS型突变较野生型细胞在胆固醇生物合成途径中富集,意味着APC/KRAS型CRC的胆固醇生物合成被激活。
2
APC/KRAS突变型CRC减少
对胆固醇摄取的依赖的同时
增加了胆固醇的从头合成
运用荧光标记的低密度脂蛋白(LDL)作为跟踪标志测量LDL胆固醇的摄取,并通过field计数和FL流式细胞术对LDL-FL荧光进行定量和半定量分析,证实了APC/KRAS突变型结直肠癌细胞对LDL摄取量降低。用氘水(D2O)同位素标记法评估从头胆固醇合成,氘掺入胆固醇的LC-MS/MS分析显示APC/KRAS突变型结直肠癌细胞中从头胆固醇合成升高,但总胆固醇水平在等基因细胞系中保持不变。这些结果表明结肠癌细胞中APC/KRAS突变减少了对胆固醇摄取的依赖,同时增加了胆固醇的从头合成。
3
APC缺失和KRAS突变
诱导了以PCSK9为关键靶点
的胆固醇生物合成途径
运用LC-MS/MS发现APC/KRAS突变型细胞诱导积累了3-羟基-3-甲基戊二酰辅酶A和香叶基香基二磷酸(GGPP)。与正常细胞相比,APC/KRAS突变型细胞伴随GPP、FPP、GGPP上调,而且GGPP的积累会促进APC/KRAS突变型细胞集落形成,表明GGPP是KRAS激活所必需的代谢物。综上所述,APC缺失伴随KRAS突变促进细胞系和小鼠胆固醇合成和GGPP积累的上调。
4
PCSK9在CRC进展中的作用
01
PCSK9过度表达会
促进肿瘤发展,且其
过度表达与APC/KRAS
的同时突变相关
02
PCSK9在APC/KRAS
突变型CRC中作为
致癌因子发挥作用,
促进APC/KRAS
突变型CRC的恶性表型
在研究PCSK9丢失后的体外效果时,还利用了PC/KRAS突变型CRC小鼠类器官进行辅助测试。并且观察到了在shPCSK9抑制机制凝胶中培养的小鼠类器官生长受到抑制(图1)。
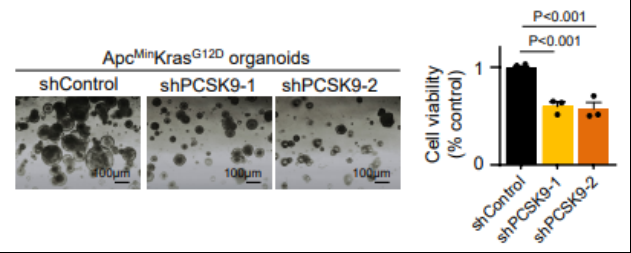
图1
03
PCSK9驱动激活胆固醇
途径从头合成和GGPP
生物合成从而推动PCSK9
在APC/KRAS突变型
CRC进展
05
PCSK9抑制剂在体内外显著
靶向抑制PCSK9在APC/KRAS
突变型CRC发展
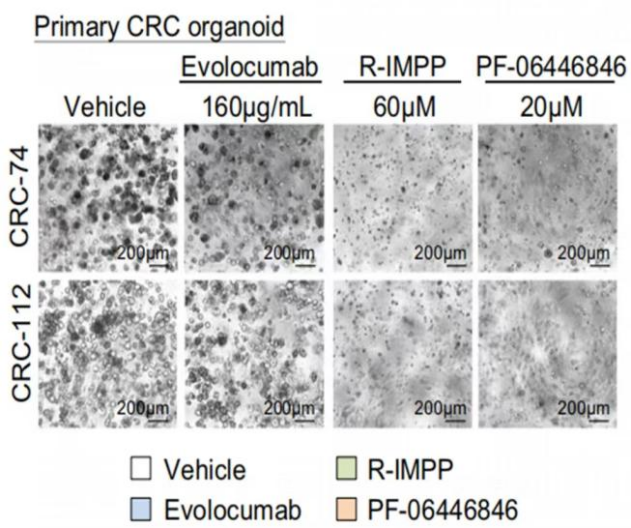
图2 PCSK9抑制剂对人APC/KRAS突变型CRC类器官有显著抑制作用
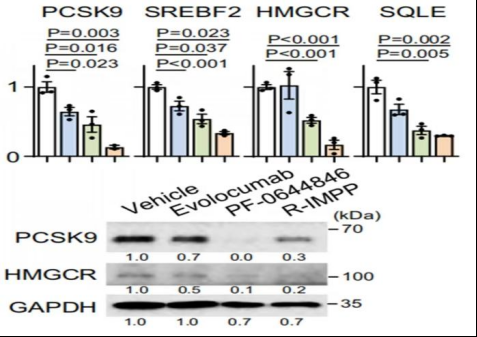
图3 通过qPCR和Wastern blot确定抑制胆固醇的生物合成途径
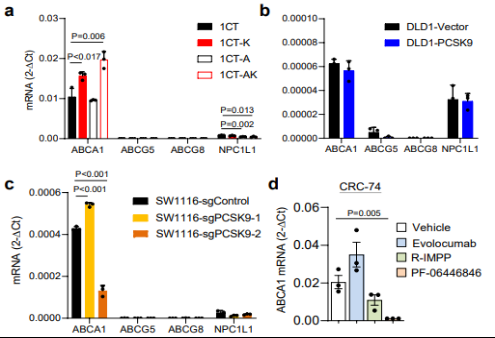
图4 PCSK9抑制剂对结直肠类器官ABCA1没有抑制作用
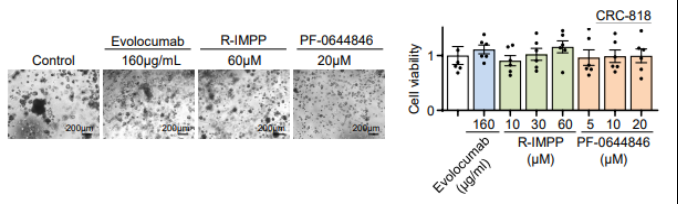
图5 PCSK9抑制剂对KRAS野生型类器官没有影响
在验证PCSK9抑制剂能够在体内外抑制突变型结直肠癌发展的实验中,运用了患者来源的APC/KRAS突变型CRC类器官进行试药,发现PCSK9抑制剂对类器官具有显著抑制作用,而PCSK9抑制剂对非PC/KRAS突变型CRC类器官则没有抑制作用或无影响。
研究亮点
研究证明胆固醇摄取调节因子PCSK9是APC/KRAS突变型结直肠癌的致癌因子。APC/KRAS突变型结直肠癌通过诱导PCSK9过度表达促进癌症发生发展进程。此外,PCSK9可以与他汀类药物联合靶向用药,从而达到抑制APC/KRAS突变的结直肠癌发展的效果。明确PCSK9可能是APC/KRAS突变大肠癌的致癌因子和潜在治疗靶点。
前景展望
从2009年类器官技术元年发展至今,类器官构建技术已经较为成熟,逐渐成为科研、临床、生产等多领域中的热门助手。2013年,类器官技术被Science评为年度生命科学技术。2019年,Science, Nature, Cell相继推出类器官特刊。2021年,疾病类类器官模型被列为我国“十四五”首批重点专项。2022年7月10日,国内首个类器官领域专家共识正式发布,推动类器官药敏技术更好帮助临床精准治疗。近几年,期刊上也越来越多出现借助类器官模型辅助研究的高质量科研文章。就如本文章,研究团队就在论证过程中运用了类器官实验的结果为结论提供证据。相信随着类器官技术的突破与经验的积累,结合产学研医的跨界合作,类器官技术一定会不断地在推动下向前发展,为科研、临床、新药研发等领域做出更多贡献。
精科类器官亮点
精科医学作为国内类器官技术转化先行者,对结直肠癌类器官的相关研究与临床应用更是走在行业前列。我们在结直肠癌类器官(原位以及转移灶)培养方面积累了丰富经验,且拥有成熟的癌组织超微量建模技术,一份微量样本可以同时实现类器官建模和NGS测序,能够在少量样本的情况下为患者提供更多检测服务,给临床患者带来更大获益。此外,我们还和多家医院和科研机构开展科研和临床合作。目前我们已经在类器官微量建模、类器官鉴定、药物敏感性检测方法、类器官共培养等多个重要技术上实现突破,并已建立相关实验室标准。
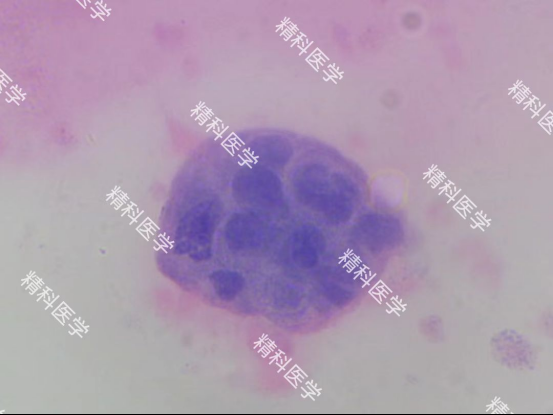
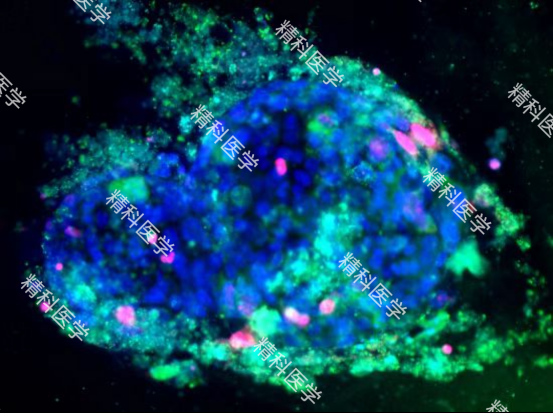
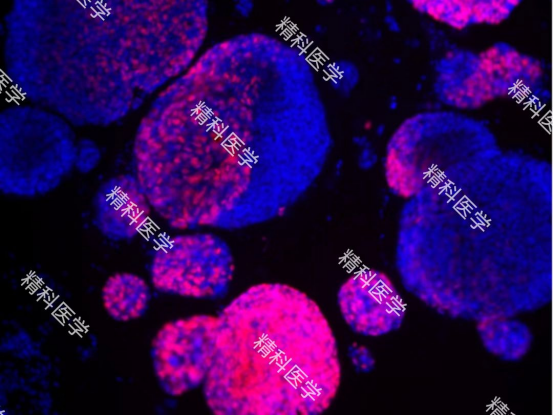
PIC. 依次为 精科肠癌类器官HE图片(图a) 精科肠癌类器官荧光照片(图b-c) 精科类器官平台用于超微量建模的肠癌肝穿样本图(图d)