25
2022-08
Citation
引文
肺腺癌是肺癌最常见的类型,属非小细胞癌,发病率和死亡率呈逐年上升趋势。近年来,基于分子靶点的精准治疗极大地改善了晚期非小细胞肺癌(NSCLC)患者的生存和疾病控制。但也只有少数含有特定突变的患者能够受益于靶向治疗,如EGFR激活突变、T790突变、BRAF V600E突变、MET外显子14跳跃突变,以及ALK、ROS1、RET和NTRK1/2/3融合。此外,驱动基因突变相同的患者对靶向治疗的反应也存在异质性,另外驱动癌基因较为罕见的分子亚型表现出不同的临床和生物学特征,进一步复杂化了晚期NSCLC患者的临床决策。
患者来源的类器官(PDO)作为临床前模型来研究肿瘤生物学,不同的模型都有其自身的局限性,细胞系包含的细胞类型过于单一,丧失了肿瘤的异质性,而人源肿瘤异种移植模型,不仅存在人鼠之间物种的差异,而且成本高昂、建模周期长和建模成功率低,也无法高通量使用等问题。PDO建模时间短,能够很好地保留了患者肿瘤的生物学特征,在精准医疗方面具有独特的价值。本文中,小编将带领大家跟随CLINICAL CANCER RESEARCH的高分文章一起探索PDO预测患者对靶向治疗的临床反应和确定针对新靶点的有效抗癌治疗。

研究目的
目前还未有PDO与晚期肺腺癌的临床相关性的研究,为此,研究团队利用晚期肺腺癌组织构建类器官用于预测患者个体对靶向治疗的临床反应,并确定针对新分子靶点的有效抗癌治疗。
研究结论
1
肺腺癌PDO高度重现亲代肿瘤遗传特征
共建立了83个肺腺癌肿瘤类器官(恶性积液=77,脑转移=3,骨转移=1,原发灶=2),成功率为83.0%(83/100)。结果表明,肺腺癌类器官与原亲本肿瘤组织学特性保持高度一致,测序结果显示在进行基因检测的41例中,类器官的驱动突变情况(38/41;92.7%)与通过常规检测(n=35)和/或靶向NGS(n=9)检测到的相应肿瘤基本一致。

图A类器官及其亲本肿瘤组织的HE和IHC染色图像;图B类器官基因组图谱
2
晚期肺腺癌PDO具有较好的预测价值
晚期肺腺癌类器官可预测患者对TKI单药治疗的反应,文中比较了EGFR阳性和ROS1阳性非小细胞肺癌患者对TKI单药治疗的无进展生存期(PFS)的体外反应(IC50),PDO对于PSF预测的准确性达到75.0%。另外RECIST(The Response Evaluation Criteria In Solid Tumors)目前已成为肿瘤治疗评价标准的基石,药物测试中,在获得部分缓解(PR)的患者中建立的大多数类器官(5/6;83.3%)中观察到了细胞生长的退化。同时在疾病稳定(SD)的患者中建立的大多数类器官(2/3;66.0%)中观察到细胞生长。测试数据表明PDO的体外药物反应与经系统治疗非小细胞肺癌驱动基因阳性患者的临床结果相关。
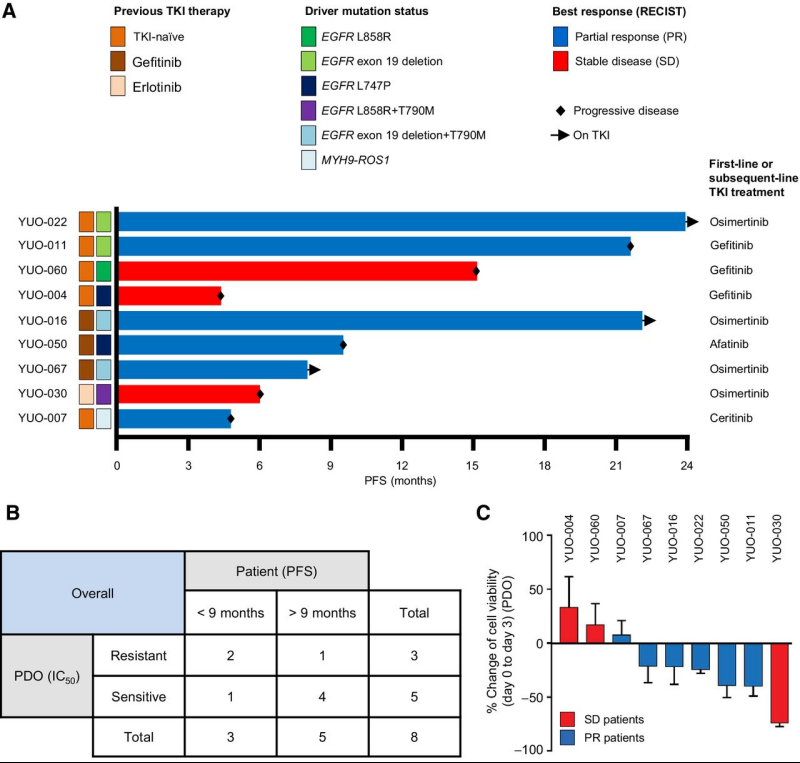
图A 9例NSCLC患者临床注释的泳池分布图;图B,PDO体外反应与匹配患者临床反应(PFS)的相关性;图C,PDO细胞活力的百分比
3
3D培养条件下的晚期
肺腺癌PDO临床相关性更好
2D培养已被广泛应用于转化研究,研究比较了2D培养物和3D PDO的临床相关性,结果证实培养条件是类器官药物敏感性的决定因素,在3D培养条件下的晚期肺腺癌PDO临床相关性更好。已有研究显示,培养条件可以调节HER家族激酶的表达或激活,并影响EGFR或ERBB2驱动的癌细胞系的药物敏感性,研究发现与3D培养条件下相比,2D培养条件下YUO-004的Src和STAT3磷酸化水平显著降低,数据表明预测临床反应需要依赖3D培养下的Src激活。
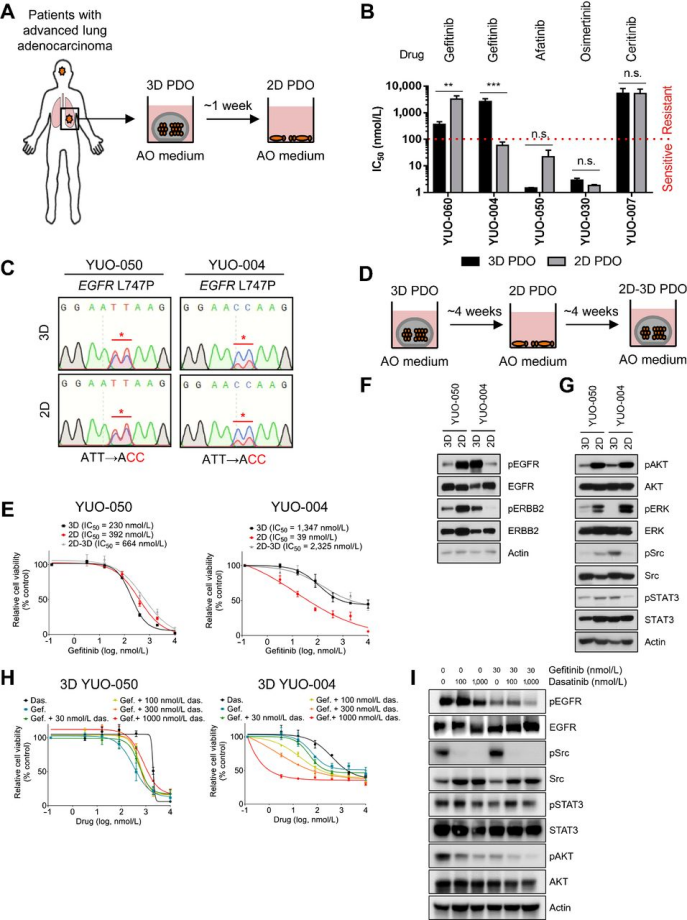
A、3D/2D-PDO生成步骤;B、3D/2D-PDO各TKI IC50值比较;C、两样本2D/3D培养EGFR L747P突变图谱;D、不同培养模式图;E、吉非替尼在两样本三种培养条件下的IC50值;F/G、两样本免疫印迹图;H、两样本3D培养条件单药或多药组合情况;I、用指定浓度的YUO-004不同药物组合处理的免疫印迹图
4
PDO在不同临床情形中的预测价值
1
PDO具备测试正在进行临床研究的新型
治疗策略的能力
对一名EGFR突变的非小细胞肺癌进展为奥希替尼耐药的患者进行研究,发现PDO可以捕捉到达拉非尼/曲美替尼联合治疗EGFR外显子19缺失+BRAF G464A突变的临床疗效反应,治疗一周后CT扫描显示肿瘤显著缩小,而类器官药物处理结果显示,达拉非尼+曲美替尼可达到74%的类器官生长抑制,其他药物处理后类器官出现增殖生长。
EGFR激活突变对第一代EGFR-TKIs有反应,而罕见的EGFR突变对治疗表现出不同的敏感性。为了确定针对EGFR L747P突变的有效治疗方法,发现阿法替尼能有效抑制EGFR下游信号成分,可以对YUO-004异种移植物的生长具有51.8%的肿瘤生长抑制(TGI),并伴有显著的EGFR磷酸化抑制,而吉非替尼和奥希替尼没有抗癌作用(TGI分别为20.6%和27.4%)。此外还发现YUO-050的匹配患者对阿法替尼有反应,获得了9.5个月的PFS。结果表明,PDO可预测阿法替尼抗EGFR L747P突变的临床活性,阿法替尼比第一代和第三代EGFR-TKIs更有效地抑制EGFR L747P突变。
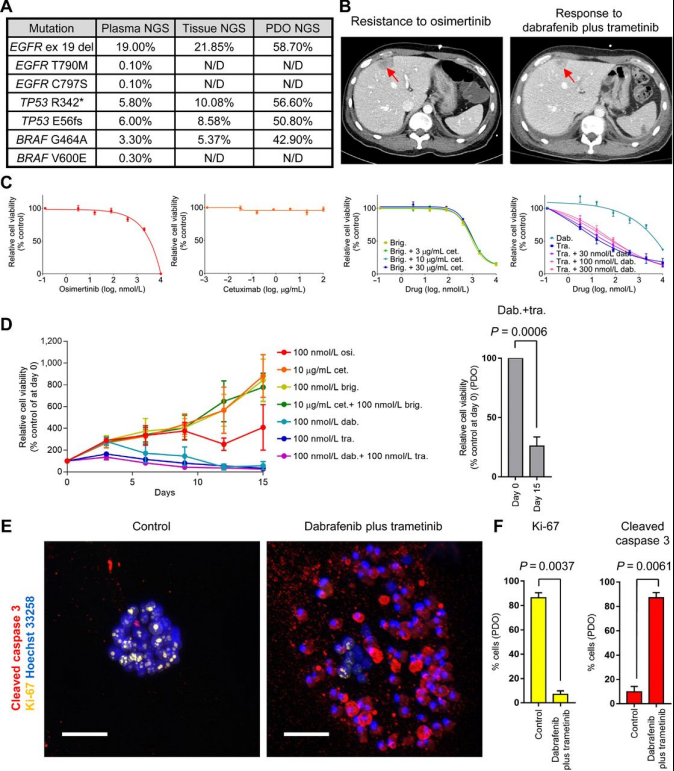
A、患者液体/组织活检以及类器官NGS总结;B、肿瘤CT扫描图(患者奥希替尼耐药和达拉非尼+曲美替尼联合治疗);C、患者不同药物处理下相对细胞活力测定(5天);D、患者不同药物处理下(15天)以及达拉非尼+曲美替尼(第0天)和(第15天)的相对细胞活力测定;E、患者免疫荧光图(对照和达拉非尼+曲美替尼联合用药);F、两组处理Ki-67/ cleaved caspase 3阳性细胞定量条形图
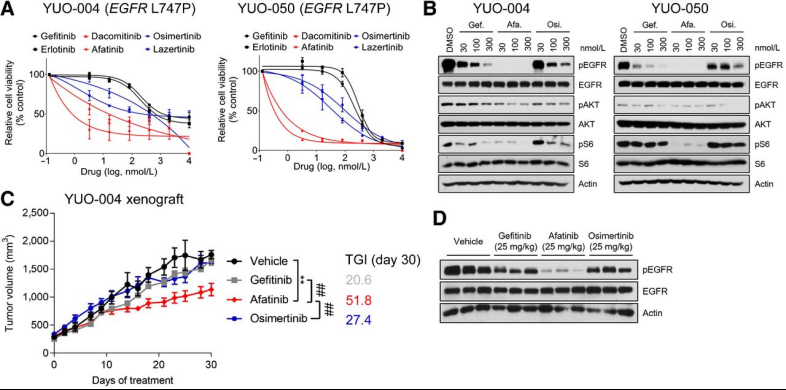
A、两样本分别用指定浓度的第一/二/三代EGFR-TKIs处理;B、两样本在指定浓度药物处理后6小时的免疫印迹图;C、YUO-004异种移植瘤在指定药物浓度下的肿瘤体积变化;D、指定药物浓度不同药物处理YUO-004异种移植的肿瘤样本的免疫印迹图
2
PDO可以为新的分子靶点确定
有效的抗癌疗法
ERBB2突变和RET融合是靶向治疗的新靶点,在大约2%的NSCLC患者中发现。研究利用类器官研究ERBB2突变和RET融合的NSCLC的有效靶向治疗,发现并强调了Poziotinib和Pralsetinib对ERBB2外显子20插入和RET融合的NSCLC的临床前疗效,对于存在ERBB2外显子20插入或RET融合的晚期肺腺癌,PDO可以识别有效的治疗方法。
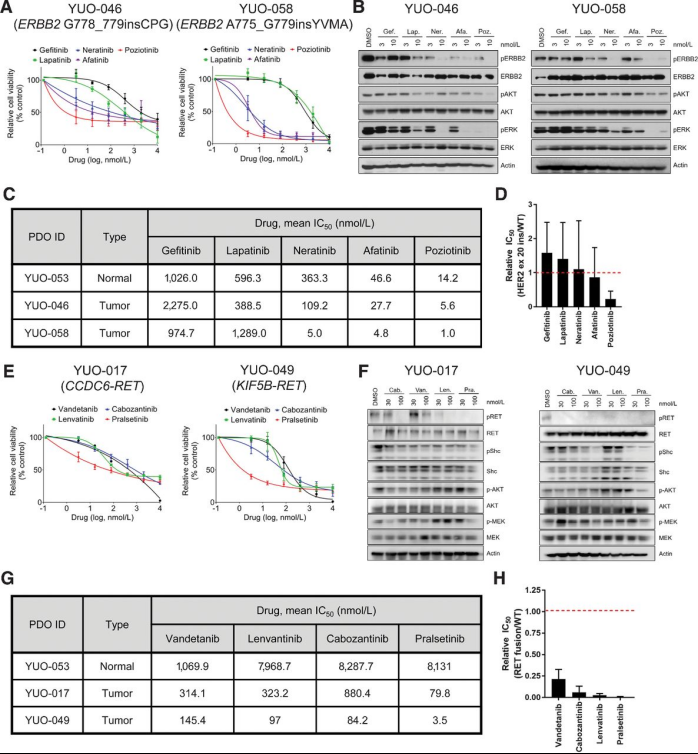
A、两个含有ERBB2外显子20插入突变的样本用指定浓度的药物处理5天;B、药物处理6小时的免疫印迹图;C、不同样本不同ERBB2抑制剂处理的IC50值(YUO-053为正常组织类器官);D、ERBB2突变型类器官中ERBB2抑制剂相对于正常类器官的平均IC50值的柱状示意图;E、两个含有RET融合突变的样本用指定浓度药物处理5天;F、药物处理2小时的免疫印迹图;G、不同样本不同RET融合靶向药处理的IC50值(YUO-053为正常组织类器官);H、RET融合突变类器官中RET融合靶向药相对于正常类器官的平均IC50值的柱状示意图
研究结论
研究证实了PDOs在晚期肺腺癌中转化相关性,PDO作为一种重要的诊断工具,可以协助临床决策和加快治疗策略的发展。
精科亮点
精科医学作为国内类器官技术转化先行者,对于肺癌类器官的相关研究与临床应用更是走在行业前列,我们在肺癌类器官培养上积累了丰富的经验,目前已完成千余例样本的建模与建库,所培养的肺癌类器官库样本类型全面。其中基于穿刺活检组织的微量建模培养成功率极高,同时可以实现穿刺标本的“一样两检”(类器官药敏+NGS)。精科拥有自主研发的肺癌类器官培养技术,能够有效地延长样本保护期,扩大地域覆盖面。此外我们还和多家医院和科研机构开展科研与临床合作。目前我们已经在类器官建模方法、类器官鉴定、药物敏感性检测方法、类器官共培养等多个重要技术上实现突破,并已建立相关的实验室标准。
前景展望
从2009年类器官技术元年发展至今,类器官构建技术已经较为成熟,逐渐成为科研、临床、生产等多领域中的热门助手。2013年,类器官技术被Science评为年度生命科学技术。2019年,Science, Nature, Cell相继推出类器官特刊。2021年,疾病类类器官模型被列为我国“十四五”首批重点专项。2022年7月10日,国内首个类器官领域专家共识正式发布,推动类器官药敏技术更好帮助临床精准治疗。近几年,类器官技术也越来越多应用于药敏试验指导临床用药并参与临床前试验助力新药、新疗法的开发。相信随着类器官技术的突破与经验的积累,结合产学研医的跨界合作,类器官技术一定会不断地在推动下向前发展,为科研、临床、新药研发等领域做出更多贡献。