09
2023-02
Citation
引文
上尿路尿路上皮癌(Upper Tract Urothelial Carcinoma,UTUC)是发生于肾盂和输尿管的尿路上皮癌。与下尿路(如膀胱)尿路上皮癌相比,UTUC预后更差、复发转移率更高。对于进展期UTUC患者,根治术后辅助化疗是其标准治疗手段,然而肿瘤异质性的存在使不同患者对化疗药物的敏感程度不同。个体化精准治疗是改善肿瘤患者预后的理想治疗手段,但针对UTUC的个体化精准医疗缺乏合适的临床前药物效果评价模型。
研究目的

研究结果
01
建立临床肿瘤组织来源的
UTUC类器官培养体系
目前,常见类型肿瘤的类器官培养体系已经建立,然而针对UTUC的类器官培养体系尚无报道。研究基于根治性肾输尿管切除术切除的组织样本,对维持类器官生长所通用的生长因子及信号通路调节剂进行测试。结果表明,R-spondin1、noggin、SB202190等常用的类器官培养基添加剂对UTUC类器官是非必需的;且EGF会显著降低UTUC类器官培养的成功率,而EGF对于正常组织来源的类器官是必需的。通过对培养体系的优化,不仅提升了UTUC类器官的培养效率,同时解决了癌旁正常组织来源的类器官的污染问题。
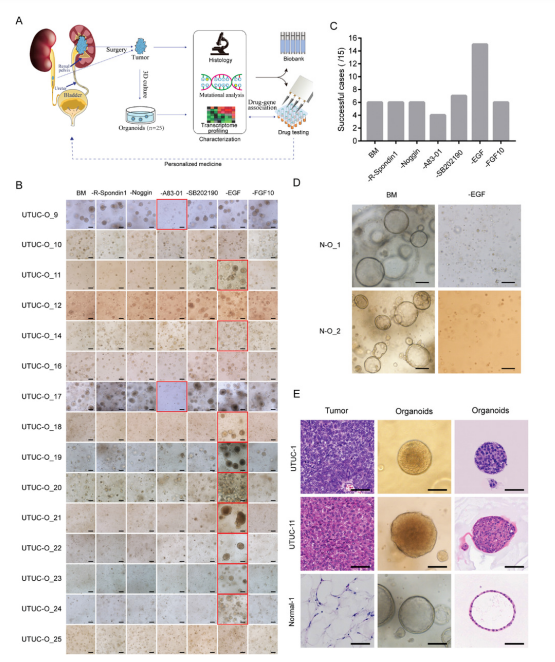
图1 UTUC类器官培养体系的建立
02
UTUC类器官维持其来源肿瘤组织的特征
为了验证培养的UTUC类器官可以精确维持其来源肿瘤组织的特征,研究对培养的UTUC类器官和其对应来源的肿瘤组织进行HE染色、免疫荧光染色、外显子组测序及转录组测序,并将结果进行对比分析。研究结果表明,建立的UTUC类器官能够保持其原始肿瘤组织的病理形态结构、基因突变特征及基因表达谱特征。
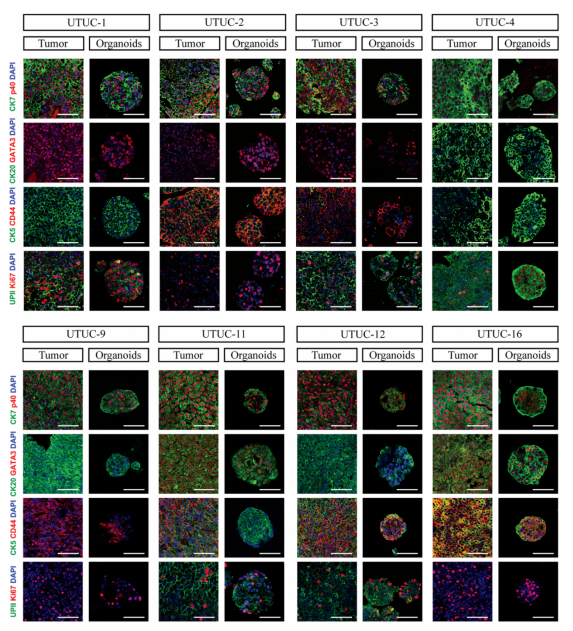
图2 患者来源的UTUC类器官保存亲代肿瘤的组织病理学特征
03
基于UTUC类器官的抗肿瘤药物的筛选
团队在成功建立了UTUC类器官模型后,利用模型验证了抗肿瘤药物的有效性,以期筛选出治疗效果更优的药物,从而指导临床治疗。研究结果表明,不同UTUC患者来源的肿瘤类器官对于抗肿瘤药物的敏感性存在巨大差异,且药物筛选结果具有稳定性及可重复性,例如FGFR3是UTUC中常见的突变基因,基于UTUC类器官的药物筛选结果表明,含有FGFR3激活突变的肿瘤类器官对Trametinib的敏感性显著高于FGFR3野生型的肿瘤类器官。
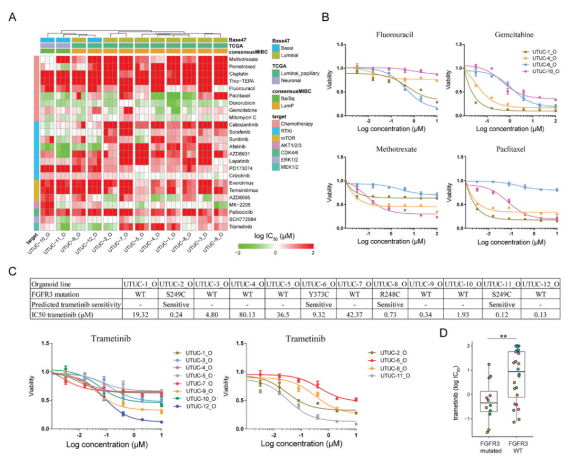

图3 基于UTUC类器官的抗肿瘤药物的筛选
04
基于UTUC类器官模型探究
吉西他滨耐药机制及潜在治疗策略
基于肿瘤类器官的抗肿瘤药物处理及scRNA-seq结果表明,UTUC类器官经过吉西他滨处理后产生了耐药性,c-Met在吉西他滨处理后的耐药细胞中表达上升,而吉西他滨联合c-Met抑制剂卡博替尼可以有效逆转吉西他滨耐药从而杀伤肿瘤细胞。
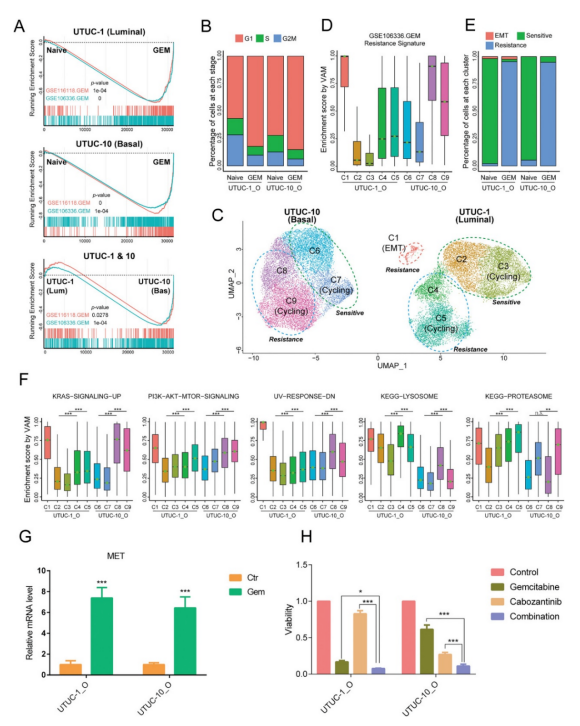
图4 基于UTUC类器官探究吉西他滨耐药潜在的治疗策略
研究结论
热评:
类器官作为一种革命性疾病模型,在干细胞与发育、再生医学、疾病研究、药物开发和精准医疗等多个领域都有广泛的应用前景。肿瘤类器官是主要的应用分支,通过患者肿瘤细胞体外培养出的,与患者肿瘤高度一致的“微肿瘤”,从病理、细胞到基因,重现肿瘤发生、发展和治疗反应,是理想的“患者替身”。利用类器官药筛作为“试药替身”能够有效识别患者的药物敏感性情况,避免无效用药,让临床患者少走弯路、少受痛苦,实现个性化精准医疗。
精科亮点
精科医学作为国内类器官技术转化先行者,我们在类器官培养上积累了丰富的经验,涵盖了乳腺癌、肺癌、胃肠癌、肝癌、膀胱癌、前列腺癌、肾癌、甲状腺癌、卵巢癌、宫颈癌、骨肉瘤以及脑肿瘤等多种实体肿瘤。其中基于活检组织的微量建模培养成功率极高,同时可以实现穿刺标本的“一样两检”(类器官药敏+NGS)。精科拥有自主研发的类器官培养技术和试剂盒,能够有效地延长样本保护期,扩大地域覆盖面。此外我们还和多家医院和科研机构开展科研与临床合作。目前我们已经在类器官建模方法、类器官鉴定、药物敏感性检测方法、类器官共培养等多个重要技术上实现突破,并已建立相关的实验室标准。
